Trägt das Substrat beispielsweise eine negative Ladung, könnte das Enzym eine negative Ladung nutzen, um das Substrat zu „stressen“ und so die Reaktion zu erleichtern.
Eine Studie der Universität Göttingen und des Max-Planck-Instituts für Multidisziplinäre Naturwissenschaften in Göttingen hat nun unerwarteterweise gezeigt, dass zwei gleiche Ladungen nicht zwangsläufig zu einer Abstoßung führen, sondern eine Anziehung in Enzymen bewirken können. Die Ergebnisse sind in der Fachzeitschrift Nature Catalysis erschienen.
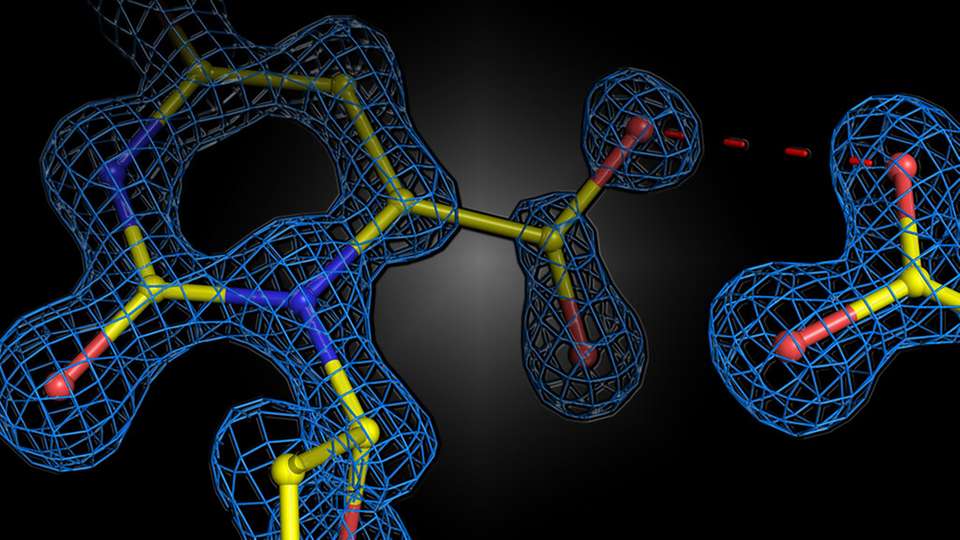
Schnappschuss kurz vor der chemischen Reaktion
Das Team studierte ein Enzym, das ein bekanntes und intensiv untersuchtes Lehrbuchbeispiel für Enzymkatalyse ist. Ohne das Enzym ist die Reaktion extrem langsam und läuft mit einer Halbwertszeit von 78 Millionen Jahren ab. Das Enzym beschleunigt die Reaktion um den beeindruckenden Faktor 1017, und zwar allein durch Positionierung von negativen und positiven Ladungen im aktiven Zentrum.
Da das Substrat eine negativ geladene Gruppe enthält, die als Kohlendioxid abgespalten wird, war man jahrzehntelang davon ausgegangen, dass die negativen Ladungen des Enzyms das ebenfalls geladene Substrat stressen und die Reaktion beschleunigen würden. Dieser mechanistische Vorschlag blieb jedoch nur hypothetischer Natur, da die Reaktion zu schnell war, um strukturell beobachtet zu werden.
Der Gruppe von Prof. Dr. Kai Tittmann vom Göttinger Zentrum für Molekulare Biowissenschaften (GZMB) gelang es nun erstmals, mit Hilfe der Proteinkristallografie einen strukturellen Schnappschuss des Substrats kurz vor der chemischen Reaktion zu erhalten. Entgegen den Erwartungen stießen sich die negativen Ladungen von Enzym und Substrat nicht gegenseitig ab. Stattdessen teilten sie sich ein Proton als molekularen Klebstoff in einer attraktiven Wechselwirkung.
„Die Frage, ob zwei gleiche Ladungen im Kontext der Enzymkatalyse Freunde oder Feinde sind, wird in unserem Fachgebiet seit langem kontrovers diskutiert, und unsere Studie zeigt, dass die grundlegenden Prinzipien der Funktionsweise von Enzymen noch lange nicht verstanden sind“, so Tittmann.
Die kristallografischen Strukturen wurden anschließend von dem Quantenchemiker Prof. Dr. Ricardo Mata und seinem Team vom Institut für Physikalische Chemie analysiert. „Das zusätzliche Proton zwischen den beiden negativen Ladungen wird nicht nur dazu verwendet, das Substrat anzuziehen, sondern es löst eine Kaskade von Protonentransferreaktionen aus, die die Reaktion weiter beschleunigen“, erklärt Mata.
Mögliche Einsatzgebiete
„Wir glauben, dass die entschlüsselten Prinzipien der Enzymkatalyse bei der Entwicklung von neuen chemischen Katalysatoren helfen werden“, sagt Tittmann. „Da das von uns untersuchte Enzym Kohlendioxid freisetzt, das wichtigste Treibhausgas, das durch menschliche Aktivitäten entsteht, könnten unsere Ergebnisse dazu beitragen, neue chemische Strategien für die Kohlendioxidbindung zu entwickeln.“
An der Studie waren Wissenschaftlerinnen und Wissenschaftler des Göttinger Zentrums für Molekulare Biowissenschaften (GZMB), der Fakultäten für Biologie und Psychologie sowie der Chemie der Universität Göttingen, des Max-Planck-Instituts für Multidisziplinäre Naturwissenschaften, des Europäischen Molekularbiologischen Labors (EMBL) Hamburg und der Universität von Toronto beteiligt. Die Publikation ist dem Andenken an den Mitautor Prof. Dr. Ulf Diederichsen gewidmet, der im vergangenen Jahr verstarb.