Eigentlich sind PFAS großartige Moleküle: Schon eine dünne PFAS-Schicht lässt Wasser ebenso abperlen wie Öl und Schmutz. Gleichzeitig sind PFAS äußerst widerstandsfähig gegenüber Hitze und UV-Licht. Das macht sie zur beliebten Beschichtung von atmungsaktiver Outdoor-Kleidung, schmutzabweisenden Teppichen, Einweggeschirr, Bügeleisen oder Pfannen, in denen die Bratkartoffeln geröstet werden anstatt anzubrennen. Industriell werden PFAS als Schmiermittel verwandt, als Tenside und Netzmittel, bei der Verchromung oder in Feuerlöschmitteln. Die Liste ist lang, PFAS finden sich fast überall.
Diese Vorzüge haben ihren Preis: Da PFAS so widerstandsfähig sind, bleiben sie auch dann in der Umwelt, wenn sie eigentlich nicht mehr gebraucht werden. Zwar lassen sich PFAS in Müllverbrennungsanlagen nahezu vollständig verbrennen. Werden Materialien wie zum Beispiel Textilien oder Klärschlamm jedoch recycelt, können sich PFAS im Stoffkreislauf anreichern und in die Umwelt gelangen, wo sie in Gewässern, Böden, Pflanzen und auch im menschlichen Körper nachweisbar sind. Dies ist besonders problematisch, weil einige der rund 4.700 PFAS-Verbindungen im Verdacht stehen, krebserregend zu sein oder andere Gesundheitsschäden hervorzurufen.
C-F-Bindungen gezielt spalten
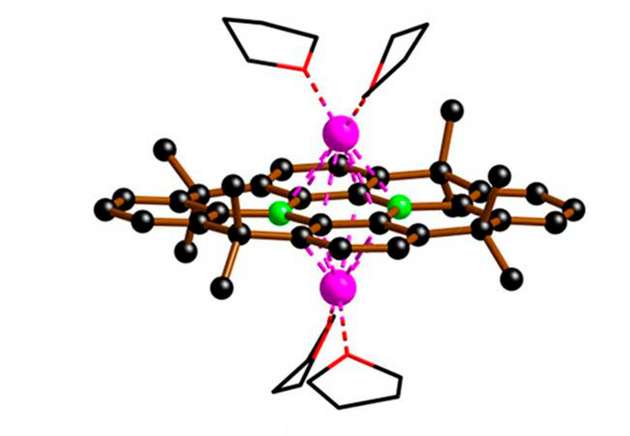
Das Erfolgsrezept – und gleichzeitig die Problematik – der PFAS liegen in ihren molekularen Strukturen, die äußerst stabile Bindungen zwischen Kohlenstoff- (C) und Fluoratomen (F) aufweisen. Chemikern um Prof. Matthias Wagner vom Institut für Anorganische und Analytische Chemie der Goethe-Universität Frankfurt ist es nun gelungen, einen Katalysator zu entwickeln, der solche C-F-Bindungen spaltet, und das innerhalb von Sekunden und bei Raumtemperatur.
Herzstück des Katalysators sind zwei Bor-Atome, die so in ein Kohlenstoffgerüst eingebettet sind, dass sie unempfindlich gegenüber Luft und Feuchtigkeit sind. Diese für Borverbindungen ungewöhnliche Eigenschaft erleichtert den Umgang mit dem Katalysator erheblich.
Christoph Buch, Doktorand in der Arbeitsgruppe von Prof. Wagner und Erstautor der Studie über den neuen Katalysator, erläutert: „Für die Spaltung der C-F-Bindungen benötigen wir Elektronen, die unser Katalysator besonders effizient überträgt. Als Quelle dieser Elektronen verwenden wir bislang noch Alkalimetalle wie Lithium. Wir arbeiten aber bereits daran, stattdessen elektrischen Strom als Elektronenquelle zu nutzen, was zu einem deutlich einfacheren und effizienteren Verfahren führen wird.“
Weitere Anwendungen möglich
Wagner sieht für den Katalysator neben dem Abbau von PFAS noch weitere Anwendungsfelder: „Sehr viele pharmakologisch wichtige Substanzen enthalten Fluoratome, um die physiologische Stabilität zu erhöhen und die Wirkung zu optimieren. Auch die Aufnahme eines Wirkstoffs kann durch den gezielten Einbau von Fluoratomen verbessert werden. Mit dem Katalysator haben wir jetzt ein Werkzeug geschaffen, mit dem man sehr gezielt den Fluorierungsgrad solcher Substanzen steuern kann.“