Um das Gebiet der industriellen Biokatalyse, die vor allem bei der Herstellung von Pharmazeutika und Spezialchemikalien zum Einsatz kommt, weiterzuentwickeln, arbeiten Forschende intensiv an neuen Prozesstechnologien. Bei der Biokatalyse beschleunigen Enzyme statt chemischer Katalysatoren die Reaktionen, damit lassen sich Rohstoffe und Energie einsparen.
Ziel ist es nun, Enzym-Biokatalysatoren unter möglichst schonenden Bedingungen kontinuierlich und in großen Mengen bereitzustellen. Damit effiziente Stoffumwandlungen realisierbar sind, werden die Enzyme in mikrostrukturierten Durchflussreaktoren immobilisiert. Sie sind dabei räumlich fixiert und an ein reaktionsträges Material gebunden und somit eingeschränkt mobil, was zu einer höheren Konzentrierung der Enzyme und damit verbunden zu einer höheren Produktivität führt.
Aufgeschäumte Mikrotröpfchen aus selbstorganisierenden Enzymen
Normalerweise verändern Enzyme beim Verschäumen ihre Struktur und verlieren damit ihre biokatalytische Aktivität. Die neuen Proteinschäume haben aber eine enorme Haltbarkeit und Aktivität. Die Aktivität ist ein Maß für die Wirksamkeit des Enzyms, das dafür sorgt, dass Ausgangsstoffe möglichst schnell miteinander reagieren.
Für die Herstellung der Proteinschäume werden zwei Dehydrogenase-Enzyme gemischt, die zueinander passende Verknüpfungsstellen tragen, sodass sie spontan ein stabiles Proteinnetzwerk ausbilden können. „Dieses Gemisch wird dann in einem mikrofluidischen Chip mit einem Gasstrom versetzt, damit sich kontrolliert mikroskopische Blasen einheitlicher Größe bilden“, erklärt Professor Christof Niemeyer vom Institut für Biologische Grenzflächen-1 den Prozess.
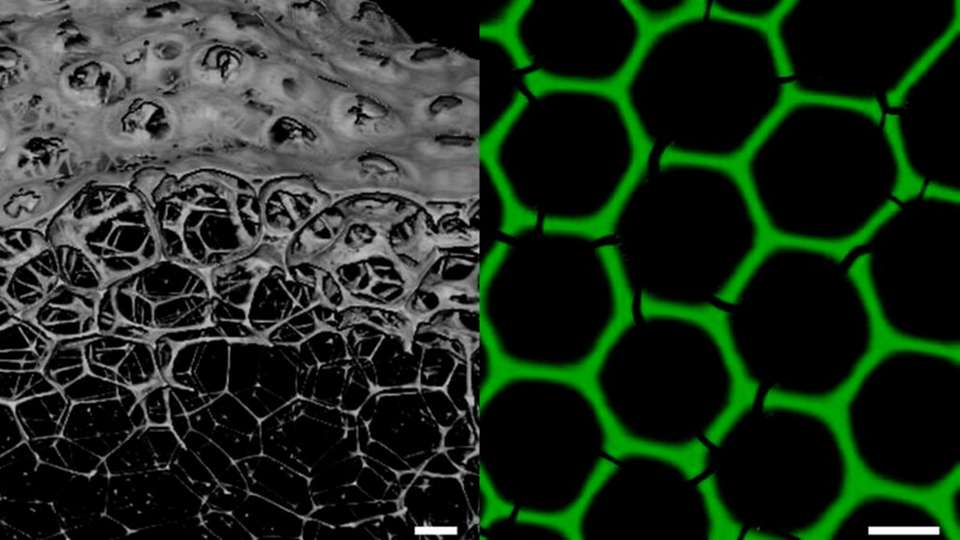
Der so hergestellte Schaum mit einheitlicher Blasengröße wird direkt auf Kunststoffchips aufgebracht und getrocknet, wodurch die Proteine polymerisieren und ein stabiles, hexagonales Gitter ausbilden. „Es handelt sich dabei um monodisperse „Voll-Enzym-Schäume“, also dreidimensionale, poröse Netzwerke, die ausschließlich aus biokatalytisch aktiven Proteinen bestehen“, charakterisiert Niemeyer die Zusammensetzung der neuen Materialien.
Die stabile hexagonale Wabenstruktur der Schäume besitzt einen mittleren Porendurchmesser von 160 µm und einer Lamellendicke von 8 µm und wird aus den frisch hergestellten, etwa gleich großen kugelförmigen Blasen nach wenigen Minuten gebildet.
Aktive und stabile Voll-Enzym-Schäume effizient einsetzen
Um Enzyme effizient für Stoffumwandlungen nutzen zu können, müssen sie in großen Mengen unter möglichst schonenden Bedingungen immobilisiert werden, um ihre Aktivität zu erhalten. Bisher wurden Enzyme auf Polymeren oder Trägerpartikeln immobilisiert, allerdings wird hierfür wertvoller Reaktorraum benötigt und die Aktivität kann beeinträchtigt werden.
„Im Vergleich zu unseren bereits entwickelten Voll-Enzym-Hydrogelen entsteht bei den neuen Materialien auf Schaumbasis eine deutlich größere Oberfläche, an der die gewünschte Reaktion stattfinden kann“, beschreibt Niemeyer die wesentliche Verbesserung.
Im Gegensatz zu theoretisch erwarteten Ergebnissen zeigen die neuen Schäume überraschenderweise eine auffallend hohe Haltbarkeit, mechanische Widerstandsfähigkeit und katalytische Aktivität der Enzyme, was bisher beim Schäumen von Proteinen nicht gelungen war.
Stabilität und Vielseitigkeit
Die Stabilität kommt, so vermuten die Forschenden, durch die zueinander passenden Verknüpfungsstellen zustande, mit der die Enzyme ausgestattet sind. Hierdurch können sie sich von selbst zusammenfügen und so während des Trocknens ein hochvernetztes Gitter bilden, das dem neuen Material eine einzigartige Stabilität verleiht.
„Erstaunlicherweise sind die neu entwickelten Enzymschäume nach der Trocknung für vier Wochen deutlich stabiler als die gleichen Enzyme ohne Schäume“, erläutert Niemeyer die Vorteile, „dies ist für die Vermarktung von großem Interesse, da hierdurch Vorratsproduktion und Versand erheblich vereinfacht werden.“
Die neuen Biomaterialien eröffnen vielseitige Wege für Innovationen in der industriellen Biotechnologie, den Materialwissenschaften oder auch für die Lebensmitteltechnologie. So könnten die Proteinschäume in biotechnologischen Prozessen eingesetzt werden, um wertvolle Verbindungen effizienter und nachhaltiger herzustellen. Das Forschungsteam konnte zeigen, dass mithilfe der Schäume der industriell wertvolle Zucker Tagatose hergestellt werden kann, der eine vielversprechende Alternative zu raffiniertem Zucker als Süßungsmittel darstellt.



.jpg)