Natrium-Schwefel-Batterien hatten ihren ersten großen Auftritt 1966: Autohersteller Ford stellte sie der Fachwelt als mögliche Stromquelle für Elektrofahrzeuge vor. Die Batterien besaßen hitzebeständige Gehäuse und wurden bei Temperaturen von über 300 °C betrieben. 27 Jahre später baute Ford einen solchen Batterietyp erstmals in Fahrzeuge ein. Doch nach mehrjährigen Tests mit 100 Prototypen des kleines Lieferfahrzeugs Ecostar, bei denen mehrmals Batterien in Flammen aufgingen, wandte sich das Unternehmen der Brennstoffzellen-Technologie zu.
Auch die US Air Force und die niederländische Marine untersuchten die Verwendung von Natrium-Schwefel-Batterien in der Raumfahrt und in U-Booten, ohne dass es anschließend zur Serienproduktion kam. Es wurde still um diesen Akku-Typ. Nur eine japanische Firma produziert heute solche Batterien mit bis zu 1,45 MWh für stationäre Anwendungen, die unter anderem von einem großen deutschen Chemieunternehmen vertrieben werden.
Alternative zu Lithium dringend gesucht
Doch in den letzten zehn Jahren hat die Forschung an Natrium-Schwefel-Batterien wieder an Bedeutung gewonnen. Weltweit suchen Forscherinnen nach Alternativen zu den heute dominierenden Lithium-Ionen-Akkus, denn Lithium ist teuer und der Abbau steht wegen der damit verbundenen Umweltbelastungen in der Kritik. Ähnliches gilt für das Metall Kobalt, das in vielen Lithium-Ionen-Akkus verwendet wird.
Im Gegensatz dazu ist Natrium in großen Mengen vorhanden und umweltschonender zu gewinnen als das verwandte Lithium, was es auch deutlich günstiger macht. Allerdings sind Akkus, die auf Natrium beruhen, schwerer und benötigen mehr Platz, um die gleiche Menge Energie wie ein Lithium-Ionen-Akku zu speichern. „Bei stationären Speichern für Wind- und Solarstrom spielt das Gewicht und der Platzbedarf jedoch keine so große Rolle wie bei Batterien für E-Autos oder Laptop-Akkus“, ist Dr. Frank Tietz vom Jülicher Institut für Energie- und Klimaforschung (IEK-1) überzeugt. „In diesem Fall sind die Kosten für die Speicher entscheidend.“
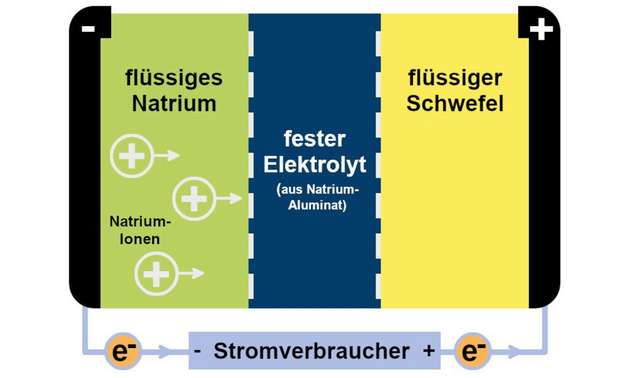
Bislang hohe Temperaturen erforderlich
Ein Faktor erschwert jedoch den wirtschaftlichen Einsatz der Natrium-Schwefel-Akkus: Sie funktionieren nur bei Temperaturen oberhalb von 250 °C zufriedenstellend, bei niedrigeren Temperaturen wandern zu wenig Ladungsträger von einem Pol zum anderen (siehe Abb. 1).
Das Team um Frank Tietz hat einen Ansatz gefunden, damit auch bei Raumtemperatur genügend Ladungsträger wandern. Dazu drehten die Forscher an zwei Stellschrauben. Der entscheidende Effekt: Sie haben die Dicke des Elektrolyten erheblich verringert. „Der flächenspezifische Widerstand des Festelektrolyten sinkt um das Zehnfache, wenn er nur ein Zehntel so dick ist wie üblich“, erläutert Frank Tietz.
Darüber hinaus haben die Forscher die Kontaktmöglichkeiten zwischen dem Elektrolyten und den beiden Polen aus Natrium beziehungsweise Schwefel verbessert. Statt den Elektrolyten wie üblich aus einer einzigen Schicht herzustellen, haben ihn die Jülicher Forscher ähnlich wie ein Sandwich aus drei Schichten aufgebaut: einer stabileren, dichten mittleren Schicht, umgeben von zwei porösen Schichten. In diese können Natrium und Schwefel eingelagert werden, wodurch sich der Kontakt des Elektrolyten zu den Elektrodenmaterialien und damit die Energiedichte der Batterie verbessert.
Energiedichte mit Potenzial
„Obwohl insbesondere auf Seiten der Schwefel-Elektrode noch Verbesserungen möglich sind, haben wir jetzt schon eine Energiedichte von rund 46 Wattstunden pro Kilogramm erzielt. Theoretisch wäre bei diesem Zellaufbau ein Wert von rund 280 Wattstunden pro Kilogramm möglich“, sagt Aikai Yang, Doktorand aus China, der den Prototyp entwickelt hat. Zum Vergleich: Aktuelle Lithium-Ionen-Akkus haben eine Energiedichte zwischen 100 und 250 Wattstunden pro Kilogramm.
„Wir werden diese vielversprechende Akku-Bauart weiter erforschen, unter anderem mit dem Ziel, großflächigere Akkuzellen herzustellen. Diese könnten dann zu kostengünstigen stationären Batteriespeichern zusammengeschaltet werden“, sagt Prof. Olivier Guillon, Direktor des IEK-1. Der neue Festelektrolyt habe bereits das Interesse der Industrie geweckt, so der Werkstoffwissenschaftler. Möglicherweise trägt er dazu bei, dass die Natrium-Schwefel-Batterie ihre neue Chance nutzen kann.
Zum Prototypen: Der Sandwich-Elektrolyt
Der Prototyp des Feststoff-Akkus hat einen Durchmesser von einem Zentimeter. Die Doktoranden Aikai Yang und Ruijie Ye haben das Herzstück dafür entwickelt, den Elektrolyten. Die Herausforderung bestand darin, eine ionenleitende Keramik herzustellen, die weniger als einen halben Millimeter dick ist, dennoch nicht bricht und aus drei definierten Schichten besteht.
Yang fand heraus, dass sich dafür ein Natrium-Yttrium-Silikat eignet. Um die drei Schichten aufzubauen, nutzte Ye die Methode des Foliengießens: Er verarbeitete eine Mischung feinvermahlener keramischer Pulver mit Wasser, einem Verflüssigungsmittel und einem Binder zu einer Art Brei, der als Schlicker bezeichnet wird. Für die Herstellung der beiden porösen Keramikschichten fügte er der Mischung noch Kügelchen aus Acrylglas hinzu. Mithilfe einer speziellen Anlage verteilte er den Schlicker gleichmäßig auf einer Gießunterlage.
Nachdem die flüssigen Anteile verdampft waren, entstand eine einheitliche und dünne Keramikschicht. Diese konnte durch Laminieren, Pressen und Erhitzen mit den beiden anderen Schichten zum festen Elektrolyten verbunden werden.














.jpg)