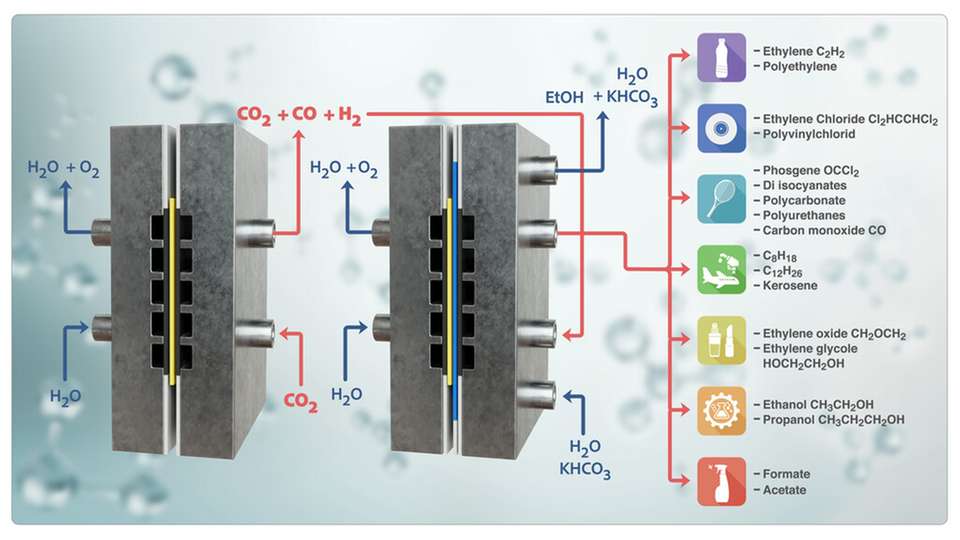
Kohlendioxid aus der Luft oder direkt aus Abgasen entnehmen und mithilfe von Strom aus erneuerbaren Quellen in wertvolle Chemikalien verwandeln – möglich macht das die Elektrolyse. Sie kann CO2 zu praktisch reinem Kohlenmonoxid (CO) reduzieren, wobei gleichzeitig Sauerstoff entsteht. Kohlenmonoxid und zusätzliches Wasser können dann in einem zweiten Schritt zu nützlichen Kohlenwasserstoffen wie etwa Ethylen reagieren, die aus längeren Ketten von Kohlenstoff- und Wasserstoffatomen bestehen.
An der TU ist nun ein Tandem-Elektrolyseur hergestellt worden, der hier eine bessere Ausbeute und Energieeffizienz als übliche Modelle verspricht. „Im Fall der Elektrolyse von Wasser und CO2 zu CO und etwas Wasserstoff als Nebenprodukt ist der Anteil von CO an der insgesamt umgesetzten Stoffmenge viel höher als bei alternativen thermischen Prozessen, die grünen Wasserstoff und CO2 verwenden, um daraus bei Temperaturen um 800 °C CO und Wasser herzustellen“, sagt Prof. Dr. Peter Strasser, Leiter des Fachgebiets „Electrochemical Catalysis, Energy and Materials Sciences“ an der TU Berlin.
Für den zweiten Schritt, die Produktion von Grundchemikalien für die chemische Industrie aus CO und Wasser, gebe es mehrere konkurrierende Verfahren. „Wenn dieser Schritt auch elektrochemisch durchgeführt wird, geschieht dies bisher oft in derselben Elektrolysezelle, in der auch das CO produziert wird“, erklärt Strasser. „Damit hier alle erforderlichen Prozesse nacheinander ablaufen können, müssen natürlich beim Katalysator und bei den chemischen Bedingungen Kompromisse gemacht werden, was zu suboptimalen Ergebnissen führt. Wir benutzen daher zwei Zellen als Tandem, bei denen die eine CO liefert, das dann in der zweiten Zelle direkt zu wertvollen Kohlenwasserstoffen umgesetzt wird.“
Dabei entstehen je nach Katalysatorformulierung im zweiten Schritt unter anderem reaktionsfreudige Kohlenwasserstoffe wie Ethylen, Propylen und etwas Acetylen. Aber auch Flüssigverbindungen wie Methanol, Ethanol und Propanol oder Acetat werden produziert.
Weniger Metall notwendig
Auch bei der Elektrode, die CO2 in CO umwandelt, gehen Strasser und sein Team neue Wege. Normalerweise wird hier als Material Silber als Katalysator für die chemischen Reaktionen verwendet. „Das ist nicht nur selten und teuer, sondern kann auch korrodieren und Filme auf der Oberfläche bilden, die die Funktion als Katalysator beeinträchtigen“, sagt Doktorand Sven Brückner, Erstautor der assoziierten Veröffentlichung. „Wir verwenden deshalb eine Kohlenstoffelektrode, in die an manchen Stellen Atome der Elemente Nickel und Stickstoff als Katalysator eingebaut wurden.“ Weil der verwendete Kohlenstoff porös ist, damit eine große Oberfläche hat und die mithilfe eines speziellen Verfahrens eingebauten Atome selbst nur an der Oberfläche sitzen, kann der Anteil des benötigten Nickels extrem klein gehalten werden – unter einem Prozent des Gesamtgewichts.
„Weil solche Elektroden erst seit ein paar Jahren existieren und immer auf den jeweiligen Anwendungszweck hin optimiert werden müssen, ist ihre Lebensdauer und auch die maximal erreichbare Katalysatorleistung noch Gegenstand der Forschung“, sagt Brückner. Weil die Elektrode unter höheren Temperaturen als der Betriebstemperatur hergestellt wird und auch weitere chemische Bedingungen während des Betriebs milder sind als bei der Herstellung, ist er aber optimistisch, dass hier bald Erfolge erzielt werden können. Die bisherige Stabilität über einige hundert Stunden hofft das Team deutlich zu verlängern.
Diagnose für längere Lebensdauer
Auch andere Betriebsparameter der Tandem-Zelle müssen noch verbessert werden. „Das Verhältnis von Kohlenmonoxid und dem Nebenprodukt Wasserstoff in der ersten Zelle hängt vom pH-Wert des Elektrolyten ab“, erklärt Brückner. Weil das Verfahren eine möglichst große Menge an CO als Baustein für Kohlenwasserstoffe liefern soll, wird die CO2-Elektrolyse unter basischen Bedingungen durchgeführt, die die Bildung von Kohlenmonoxid begünstigen. „Das führt jedoch dazu, dass die OH-Ionen im basischen Elektrolyten zusammen mit dem CO2 zu Karbonat reagieren, das sich ablagern und so die Zelle schädigen kann.“ Hier komme es also auf einen optimalen Kompromiss zwischen den verschiedenen Stellschrauben bei der Elektrolyse an.
Um den zu finden, hat das Forscherteam einen speziellen Koeffizienten entwickelt, mit dem sich die optimalen Prozessbedingungen leichter ermitteln lassen. Er enthält in einer mathematischen Formel die Produktionsraten von CO und Wasserstoff sowie die am Ausgang der ersten Zelle immer noch vorhandene Menge an CO2. „Wir messen die Konzentrationen dieser Stoffe in einem Gaschromatographen. Zusätzlich bestimmen wir auch die Konzentration des Gases Stickstoff, das wir in einer definierten Menge zugeben“, sagt Brückner.
Mit dieser „Kalibrierung“ lasse sich die Gesamtflussrate durch die Zelle bestimmen. Weil all diese Werte ständig während des Betriebs der Zelle erhoben werden können, lassen sich die Auswirkungen von Änderungen der Betriebsparameter sofort feststellen. Gleichzeitig dienen die Messwerte auch als Frühwarnsystem, wann ein Versagen der Zelle droht und Gegensteuern erforderlich ist.
Nachhaltige Kohlenstoffökonomie
„Ziel dieser Forschungen ist letztlich die Etablierung einer zirkulären, nachhaltigen Kohlenstoffökonomie“, fasst Strasser zusammen. „Ein großer Vorteil unseres Verfahren ist dabei auch, dass wir für die direkte Elektrolyse von CO2 zu nützlichen Kohlenwasserstoffen unter Verwendung von Strom und Wasser keinen zusätzlichen Wasserstoff benötigen.“
Anders sei dies bei herkömmlichen nachhaltigen Verfahren, die entweder schon zur Umwandlung von CO2 in CO oder aber zur Herstellung der Kohlenwasserstoffe aus CO Wasserstoff verwenden, der mit zusätzlicher Energie hergestellt, gespeichert und gegebenenfalls auch noch transportiert werden muss. „Basischemikalien, die auf CO2 aus der Luft statt auf Erdöl als Kohlenstoffquelle zurückgreifen, können unter bestimmten Bedingungen den Kohlendioxidgehalt der Atmosphäre tatsächlich reduzieren. Grüne E-Kraftstoffe aus CO2 haben nach ihrer Verbrennung zumindest eine ausgeglichene Kohlenstoffbilanz“, resümiert Strasser.