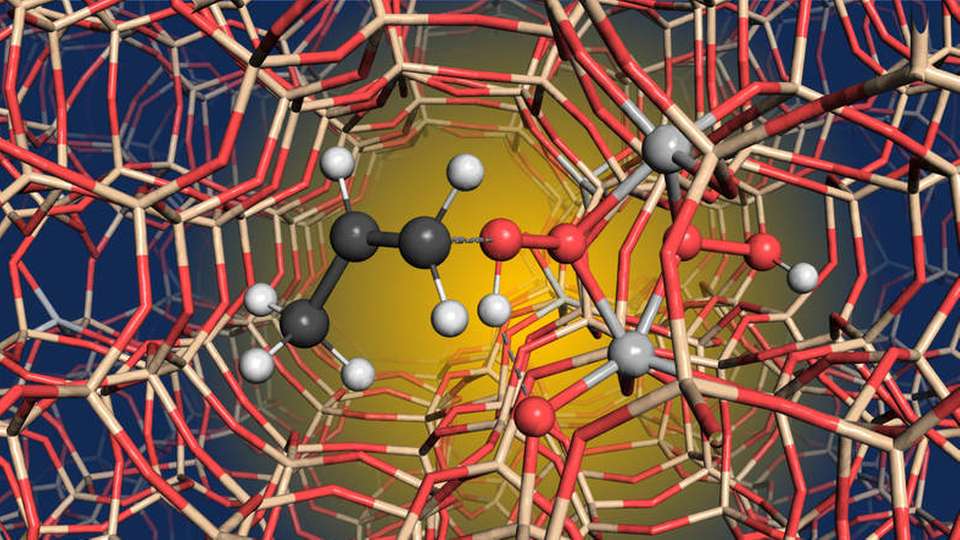
Propylenoxid wird in der Chemieindustrie eingesetzt, um zum Beispiel Polyurethane, Frostschutzmittel und Hydraulikflüssigkeiten herzustellen. Mehr als elf Millionen Tonnen Propylenoxid werden jedes Jahr weltweit produziert, davon schon jetzt eine Million durch die Oxidation von Propylen mit Wasserstoffperoxid.
Die chemische Reaktion wird katalysiert durch Titansilikalit-1 (TS-1), ein mikroporöses, kristallines Material, das aus Silizium, Sauerstoff und kleinen Mengen Titan besteht. Der Katalysator wird bereits seit 40 Jahren genutzt, und die Fachwelt ging davon aus, dass das aktive Zentrum im TS-1 einzelne, isolierte Titanatome enthält, die für die besondere Reaktivität des Katalysators sorgen.
Ein Forscherteam der ETH Zürich, der Universität Köln, des Fritz-Haber-Instituts und der BASF hat diese Annahme infrage gestellt. „In den vergangenen Jahren kamen Zweifel auf, ob die Annahme über den Wirkmechanismus korrekt ist, da sie sich hauptsächlich auf Analogien zu vergleichbaren Katalysatoren stützt und weniger auf experimentellen Beweisen“, erklärt BASF-Wissenschaftler Dr. Henrique Teles. „Wenn man aber versucht, auf Basis einer falschen Annahme einen Katalysator zu optimieren, ist das sehr schwierig und kann einen in die völlig falsche Richtung führen.“
Es sei daher wichtig gewesen, diese Annahme genauer zu überprüfen.
Reaktionsmechanismus nach langer Zeit entschlüsselt
In einer Studie, die jetzt in „Nature“ veröffentlicht wurde, konnten die Wissenschaftler unter anderem mithilfe von Festköper-NMR-Untersuchungen und Computermodellierungen zeigen, dass zwei benachbarte Titanatome nötig sind, um die besondere katalytische Aktivität zu erklären. Dies wiederum ließ darauf schließen, dass die Titanatome nicht isoliert vorliegen, sondern das katalytisch aktive Zentrum aus einem Titan-Paar besteht. Dieses ist es auch, das das Wasserstoffperoxid aktiviert.
Viele Jahre hätten die Forscher an der Aufklärung dieses Reaktionsmechanismus gearbeitet, wie Prof. Albrecht Berkessel von der Universität Köln berichtet. „Es war wirklich ein besonderer Moment, als wir in der aktuellen Untersuchung gesehen haben, dass die Erkenntnisse aus der homogenen Katalyse auch für die heterogene Katalyse zutreffen“, sagt er.
Und Dr. Thomas Lunkenbein vom Fritz-Haber-Institut in Berlin ergänzt: „Wir freuen uns sehr, dass wir einen Beitrag zu dieser Studie leisten konnten. Mit unserer Analytik konnten wir die Schlussfolgerungen untermauern. Die Erkenntnis eines zweiatomigen aktiven Zentrums ist von grundlegender Bedeutung und eröffnet neue Möglichkeiten in der Katalysatorforschung.“
Bestehende Katalysatoren verbessern und neue entwickeln
Die Wissenschaftler sind überzeugt, dass die Erkenntnisse ihrer Studie nicht nur dazu beitragen werden, bestehende Katalysatoren zu verbessern, sondern auch neue homogene und heterogene Katalysatoren zu entwickeln.
„Keine der Methoden, die wir in der Studie verwendet haben, ist grundsätzlich neu“, betont dabei Prof. Christophe Copéret von der ETH Zürich, „dennoch hätte keine der beteiligten Forschungsgruppen allein die Untersuchung durchführen können.“ Nur die Kombination aus unterschiedlichen Kenntnissen, Erfahrungen und Techniken habe es möglich gemacht, zu den neuen Ergebnissen zu kommen, die den bisherigen Annahmen in der Literatur widersprechen.